чем можно погасить азотную кислоту в домашних условиях
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
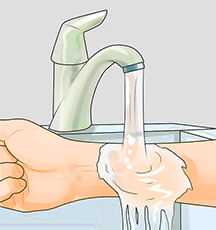
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Форум химиков
как избавиться от азотной кислоты?
как избавиться от азотной кислоты?
Сообщение StYV » Пн ноя 07, 2005 6:22 pm
Re: как избавиться от азотной кислоты?
Сообщение Bolverk » Пн ноя 07, 2005 7:11 pm
Сообщение StYV » Пн ноя 07, 2005 7:47 pm
Сообщение Bolverk » Пн ноя 07, 2005 8:01 pm
Сообщение StYV » Пн ноя 07, 2005 8:26 pm
Re: как избавиться от азотной кислоты?
Сообщение avor » Пн ноя 07, 2005 9:05 pm
1. Странно, но никогда не слышал, чтобы азотка мешала опредению металлов, да и фосфора тоже вроде не сильно мешает.
2. Обычно азотку просто удаляют прокаливанием образцов.
3. Если вам не подходит прокаливание можно ее восстановить, например сульфиды восстанавливают азотку при нагревании, сами в основном превращаясь в серу, которая легко отделяется от раствора в виде осадка. Так же можно использовать легкоокисляемые органические вещества, например тот же формалин.
До аммиака вы загнули это нужен бешенный востановитель, чтобы из азотки получить аммиак, обычно дальше азота дело не заходит, а чаще всего образуются различные окислы наиболее стойкие закись и двуокись.
—А может на ионообменной колонке прогнать?
—-Это очень сложно для аналитики.
За чтоже вы так аналитику. Аналитика абсолютно не брезгает хроматографией вообще и ионообменной в частности.
А процедура то выглядит элементарно: На фильтре вроде Шотта промываете смолу АВ-17-8(любой анионообменник подойдет) промываете ее 1М солянкой потом водой потом 1М щелочью потом водой потом загружаете ее анионом вам нужным(например хлоридом или ацетатом сооответственно повар. солью или ацетатом натрия) и потом пропускаете сквозь смолу ваш образец и промываете смолу несколькими обьемами воды, обьединяя с образцом промывки. Все! Дело сделано большинство анионов в вашем растворе заменилось на тот, что вы заказали.
Это что безумно сложная операция?
Приготавление стандарт титра из перманганата калия с последующей его оттитровкой на мой взгляд сложнее.
Сообщение StYV » Вт ноя 08, 2005 8:25 am
Сообщение Nord » Вт ноя 08, 2005 9:12 am
Сообщение StYV » Вт ноя 08, 2005 9:23 am
Сообщение Nord » Вт ноя 08, 2005 12:22 pm
Ну, я помню, что нитрит-ионы, и кажется, нитраты при кипячении в растворе с мочевиной реагируют до азота и углекислоты.
Я не готовое решение предлагаю, а лишь путь.
Сообщение avor » Вт ноя 08, 2005 1:04 pm
Вот видите теперь более или менее становится ясным вопрос.
1) Не знаю аналитики бора. Но возможно ему нитраты и мешают. Помню только прелестную реакцию со спиртом в пламени замечательный зеленинький цвет. Кстати, может вам вместо удаления нитрата, испарить бор в виде борорганики.
2)Образцы тысячами не значит, что методика должна быть простой. Это всего лиш вопрос автоматизации. Например методика секвенирования ДНК не может быть названа простой, однако для программы «Геном человека» она была автоматизирована так, что стали возможны сотни тысячь анализов. При чем каждый последующий геном обходится дешевле первого и делается быстрее.
3) Опишите эксперимент.
4) Замена иона в ионообменнике не сравнима по простоте и возможности автоматизации с ВЭЖХ. Например, я себе представляю недорогую установку в которой легко можно обрабатывать до 400 образцов одновременно.
6) нет у меня ссылки, сам на уроке делал(давно это было), да в любом кач. анализе, что-то подобное должно быть описано.
Есть еще предложения.
а) Пркаливание с силикатами улетучивает нитраты. Потом можно выщелачивать из королька бор щелочью.
Аммиачная силитра разлагается с выделением закиси азота. Намек поняли. Нечто подобное предлагал Норд.
И поймите меня правильно, для меня поставленная вами задача также нова, как и для вас. И я думаю для любого из тех кто читает здесь наши опусы. Поэтому высказанное есть только идеи, а не решение проблемы.
А проверять вам и решать стоит проверять или нет тоже вам.
А все пространные рассуждения с самого начала были вызваны расплывчатостью заданного вопроса.
Чем можно погасить азотную кислоту в домашних условиях
Здравствуйте, уважаемые форумчане. Будет много букофф. Мой первый опыт в аффинаже. Протравил немного мелких деталей от часов времен СССР, плюс немного контактов от машинки для счета денег времен перестройки (они там довольно жирные). Профильтровал и в ЦВ. Правда, тупонул слегка, сделал ЦВ не 3:1, а 4:1(всмысле соотношение соляной и азотной к-т), растворилось все очень быстро, профильтровал, получился прозрачный желтый раствор. Изначально сырья растворял немного, поэтому ЦВ сделал 45 мл. После фильтрований и промывки фильтров получилось желтого прозрачного красивого раствора примерно 250 мл (фото 3). Раствор простоял 12 часов, не изменился, не помутнел. Тест хлоридом олова положительный (фото 4).
Поскольку это мой первый блин, я начинаю сильно волноваться, когда же вылезет первый ком. Поэтому, хоть и перечитал много полезной инфы на форуме, нужен практический совет по моим дальнейшим действиям. Такие вопросы мучают меня:
1. Как лучше нейтрализовать азотку? Думаю, что раствор уже достаточно разбавлен водой, добавить серной кислоты 0,05 мл (пол кубика) и выпарить раствор из 250 мл до 100 мл?
2. Подойдет ли для этих целей обычный, не выпареный элкетролит? Серной кислоты у меня нет.
3. Вопрос по осаждению, осаждать думаю ЖК, растворить 13 грамм в воде. В каком примерно количестве воды растворять, если буду осаждать 100 мл раствора? И подойдет ли такой ЖК, как на фото 5? Куплен в огородном магазине.
Еще есть некоторые вопросы, но особенно актуальны вышеуказанные.
Сегодня выходной, в гараже стоит желтый раствор, у меня горит в одном месте что-то с ним сделать :w00t:, но буду не спешить, очень надеюсь на Вашу помощь и советы.
Свойства
Водный раствор хлористого водорода разной концентрации – это соляная кислота. Чаще всего используется раствор с концентраций хлористого водорода 36-38%. Плотность – 1,19 г/см3
Кислота с такой концентрацией испускает молекулы хлористого водорода – дымится. При уменьшении в растворе содержания этого соединения его выделение прекращается.
Чистая кислота не имеет цвета. В технических целях применяется раствор с содержанием примесей железа, хлора и других веществ. Он желтоватого оттенка.
Причины повышения кислотности
Организм – слаженная система, в которой неполадки в работе одного органа могут вызывать нарушения в функционировании другого. Но когда речь идет о высокой кислотности желудка, стоит рассматривать внешние факторы, то есть питание человека.
Кислота в желудке необходима для того, что подготовить пищу к ее перевариванию в кишечнике. Отсюда следует, что если кислоты много настолько, что встает вопрос о том, чем нейтрализовать кислоту, есть резон предположить, что человек употребляет слишком большие объемы еды. Желудок, не справляясь с нагрузкой, вынужден повышать уровень кислотности, чтобы ускорить процесс переваривания, не уменьшая его качества, то есть чтобы пищевая масса поступала в кишечник в необходимом виде.
То же самое касается ситуации, когда человек употребляет обычные объемы еды, но все продукты в рационе тяжелые и грубые для переваривания. Таким образом, желудок привыкает функционировать только в таких условиях, и даже в том случае, если человек по каким-либо причинам перестает перегружать организм едой, уровень кислоты останется высоким, и это будет ощущаться в виде изжоги, боли, тошноты.
Применение
При нагревании соляная кислота становится летучей. Она взаимодействует с большинством металлов. Исключение составляют платина, вольфрам, золото, серебро и свинец.
Используется в промышленности для извлечения металлов из руд и для травления металлов. Также она присутствует в составе некоторых соединений, например, в царской водке и в паяльной жидкости.
Воздействие на человеческий организм
Соляная кислота ядовита. Воздействие на организм человека проявляется в следующих заболеваниях:
При работе с соляной кислотой необходимо использовать защитную одежду и обувь. Органы дыхания защищать при помощи противогаза.
Хранение и транспортировка
Длительное хранение осуществляется в наземных покрытых изнутри слоем резины вертикальных резервуарах. Давление допускается атмосферное. Также соляную кислоту можно хранить в стеклянных бутылях емкостью в 20 литров. Максимальный объем хранения – 370 тонн.
Транспортируют соляную кислоту в металлических цистернах, баллонах, контейнерах. Они тоже должны быть гуммированы (покрыты слоем резины).
Нейтрализация соляной кислоты
Для нейтрализации соляной кислоты используются водные растворы щелочей:
Разлитую на земле соляную кислоту можно нейтрализовать при помощи воды. Ее подавают при помощи поливочных или пожарных машин. Загрязненный соляной кислотой грунт нужно срезать и вывезти на утилизацию.
Инструкция по нейтрализации отработанной серной кислоты аккумуляторных батарей
Утверждаю: Директор ООО » » _______________ В.В.Иванов « ____ » ____________ 2020г.
Инструкция по нейтрализации отработанной серной кислоты аккумуляторных батарей (2 класса опасности). 1. Общие требования безопасности. При сборе, хранении, нейтрализации отработанной серной кислоты от аккумуляторных батарей следует учитывать особенности ее эксплуатации и степень опасности. Природные воды имеют нейтральную, слабокислую или слабощелочную реакцию, рН их находится в пределах 6.5 — 8,5. Электролит имеет кислую рН среду и представляет собой серную кислоту плотностью 1,2 — 1,27. Аккумуляторная серная кислота является достаточно концентрированной и не подлежит утилизации без предварительной нейтрализации. Растворы серной кислоты оказывают вредное воздействие на организм человека. При нагревании серной кислоты образуются пары сернистого ангидрида, которые, соединяясь с парами воздуха, образуют кислотный туман. При вдыхании паров серной кислоты раздражаются и прижигаются слизистые оболочки верхних дыхательных путей. При попадании на кожу серная кислота вызывает сильные ожоги, болезненные и трудно поддающиеся лечению. Попадание серной кислоты в глаза грозит потерей зрения. Персонал, занятый нейтрализацией аккумуляторной серной кислоты, должен работать в одежде из кисло-защитной ткани, прорезиненных фартуках, резиновых сапогах, резиновых кислостойких перчатках, защитных очках или щитках из оргстекла, иметь фильтрующий противогаз марки В. Места сбора и нейтрализации аккумуляторной серной кислоты должны иметь предупредительные надписи. 2. Требования безопасности перед началом работы.
Получить инструктаж от ответственного за нейтрализацию, о мерах безопасности и производственной санитарии при работе с аккумуляторной серной кислотой. Подготовить и проверить исправность защитных средств, приспособлений и другого инвентаря. Следует иметь в виду, что любые разбавленные растворы серной кислоты, к которым относится и электролит, крайне • агрессивны. Вследствие этого нейтрализацию электролита необходимо проводить с максимально возможной быстротой и без перерывов.
Разработал руководитель экологической службы организации_____________ Согласовано: Инженер по охране труда _______________________________
Симптомы и последствия ожога серной кислотой
Серная кислота — это маслянистая бесцветная жидкость, не имеющая запаха. Используют ее в производстве минеральных удобрений, в текстильной, пищевой, нефтяной, металлообрабатывающей промышленности.
Это очень едкое вещество и попадая на кожу, слизистые оболочки или дыхательные пути, вызывает тяжелые ожоги.
Степень повреждения зависит от концентрации вещества и длительности его воздействия. Слабые разбавленные растворы химиката вызывают ожоги первой степени и при длительном контакте – второй. Более концентрированная жидкость приводит к тяжелым формам повреждений.
Способы лечения ожогов серной кислотой
Человек, получивший ожог серной кислотой нуждается в длительном и комплексном лечении. Проводит его врач комбусиолог. Основная задача снизить уровень дискомфорта и восстановить поврежденные ткани. Лечение проводится по следующей схеме и включает в себя:
При серьезных ожогах врач принимает меры по поддержке жизненных функций организма и предупреждения развития осложнений. Пациенту рекомендуется выполнять небольшие пассивные упражнения, которые помогут сохранить мышечную массу.
Симптомы при ожоге серной кислотой
Незначительное воздействие слабого раствора кислоты на кожу проявляется небольшим покраснением со светлой коркой по краям. Если вовремя не удалить вещество, могут образоваться пузыри. Поначалу поврежденный эпидермис будет белесого цвета, далее кожа потемнеет до серого или коричневого оттенка.
Предлагаем ознакомиться «Родинка», анализ рассказа Михаила Шолохова
Симптоматика химического ожога серной кислотой отличается от обычной термической травмы и зависит от места локализации вещества.
Ожог глаз серной кислотой
Самым опасным состоянием считается попадание ядовитого вещества на слизистую глаз. Сразу после взаимодействия кислоты с глазом, человек начинает чувствовать сильное жжение, резкую боль, появляется обильное слезотечение. Яркий свет вызывает болезненные ощущения. Дальнейшее развитие болезни сопровождается такими симптомами:
Глубокий ожог приводит к полной потере зрения даже несмотря на своевременную медицинскую помощь.
Как устранить избыточную кислоту в желудке? Самый популярный способ — это использовать обыкновенную пищевую соду. Она нейтрализует кислоту, и этот факт понятен каждому, знакомому с законами химии. Ведь сода – щелочь, а она является антагонистом кислоты.
Таким образом, зная, что сода нейтрализует кислоту, многие люди регулярно употребляют ее при признаках изжоги или боли в желудке. Действительно, сода оказывает кратковременный эффект снижения кислотности. И если под рукой нет других средств, чтобы понизить кислотность, вполне можно воспользоваться раствором соды.
Но при этом важно знать о процессе внутри организма при приеме соды. Она действует как всасывающий кислоту антацид, поэтому сразу после ее приема количество кислоты действительно понижается. Но взаимодействие соды и кислоты становится катализатором выработки углекислого газа. Газ, в свою очередь, оказывает стимулирующее действие на клетки желудка, которые продуцируют кислоту, и количество кислоты снова повышается, причем ее становится больше, чем до употребления разведенной в воде соды.
Поэтому люди, убежденные, что сода нейтрализует кислоту и является лучшим способом лечения проблемы повышенной кислотности желудка, вынуждены постоянно прибегать к данному методу.
А это, в свою очередь, приводит к защелачиванию крови. Человек, столкнувшийся с этим явлением, знаком и со всем перечнем неприятных симптомов: потеря аппетита, боль в животе, тошнота и рвота, судороги в мышцах. Также большое количество соды, а следовательно, и натрия, который в ней содержится, приводит к повышению давления, проблемам с почками, отекам.
Самым безобидным последствием регулярного употребления соды является урчание в кишечнике и диарея.
Таким образом, хоть сода (щелочь) нейтрализует кислоту, чрезмерное употребление ее небезопасно и для здорового человека. А беременным и кормящим женщинам, людям с повышенным давлением и хроническими заболеваниями ЖКТ и вовсе строго противопоказано такое лечение. Поэтому необходимо искать иные способы того, чем нейтрализовать кислоту в организме.
Кислоты
Прежде чем рассмотреть способы понижения кислотности, важно понимать, о какой именно кислоте идет речь и какие кислоты бывают.
Кислота, которую вырабатывает желудок человека, носит название «соляная». Она способна расщеплять попадающую в желудок пищу, но при нормальной концентрации она не наносит никакого вреда стенкам желудка. Тем более что она превосходно нейтрализуется за счет состава желудочного сока.
Если человек употребляет большое количество белковой пищи, то и кислоты в его организме начинает продуцироваться больше. Со временем кислота продолжает вырабатываться в прежнем объеме, даже если человек сократил употребление белков или перестал есть их совсем. Желудку нужно время для того, чтобы перестроиться, а пока человек вынужден искать действенные и безопасные способы, чем нейтрализовать соляную кислоту.
Важно знать, что никаких других кислот в нашем желудке нет, а если они туда каким-либо образом попадают, это может повлечь за собой самые страшные последствия, вплоть до смерти человека. Поэтому советы по поводу того, чем нейтрализовать серную кислоту в желудке, не имеют никакого смысла. Серная кислота используется для осушения газов или в качестве добавки к удобрениям, в органах пищеварения ее нет и не должно быть.
То же самое касается намерений нейтрализовать ортофосфорную кислоту в желудке, которая не может там оказаться никаким образом, если только человек не решит добавить в свой обед средство от ржавчины. Поэтому, встречая в рецептах или на упаковках БАДов такую информацию, следует знать, что от таких средств нужно держаться подальше.
А вот уксусная кислота в виде водного раствора вполне может попасть в наш желудок извне и не принести никакого вреда при соблюдении разумной дозировки. Заправки для салатов или маринады для мяса часто делаются из столового уксуса. В чистом виде уксусная кислота смертельно опасна, но даже столовым уксусом можно сильно отравиться. В этом случае необходимо думать не о том, чем нейтрализовать уксусную кислоту, а быстро вызывать скорую помощь и самостоятельно промывать желудок, принять любое растительное масло или смесь из яиц и молока. Категорически запрещается давать пострадавшим соду.
Утилизация кислот в домашних условиях
Ядовитые вещества используются и в быту. Выбрасывать уксусную эссенцию категорически запрещено. Уничтожение их в домашних условиях осуществляется по правилам:
При работе с токсическими веществами соблюдаются строгие правила безопасности. Работники должны надевать защитные костюмы, маски и перчатки.
При попадании на кожу, место воздействия промыть большим количеством воды. При необходимости нужно обратиться к врачу.
Выбрасывать уксус с истекшим сроком годности также запрещено.
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
4. Азотная кислота частично разлагается при кипении или под действием света:
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Еще пример : азотная кислота окисляет иодоводород:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.




