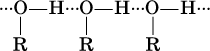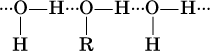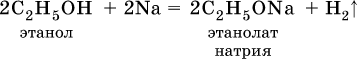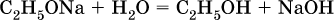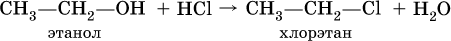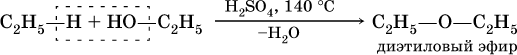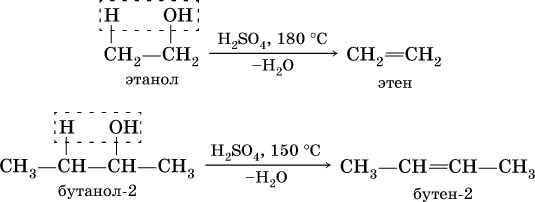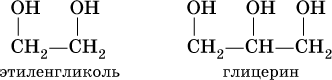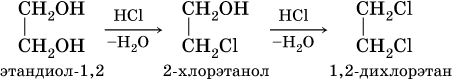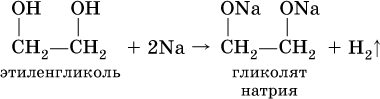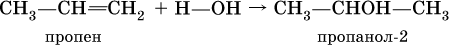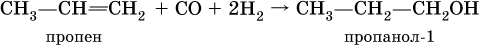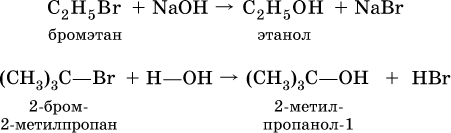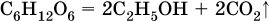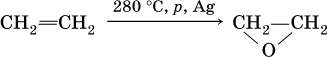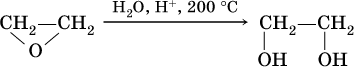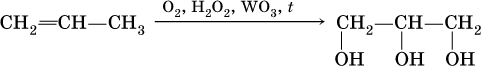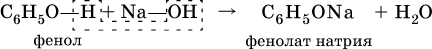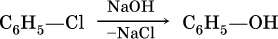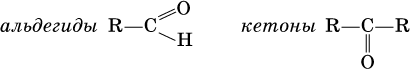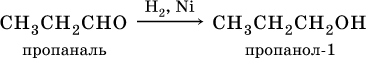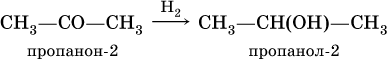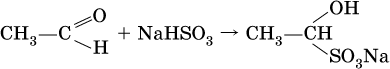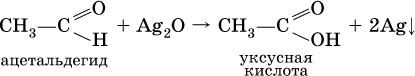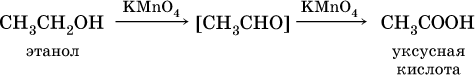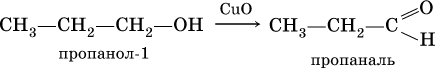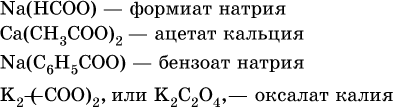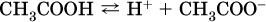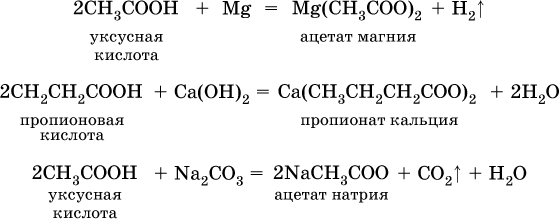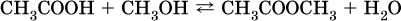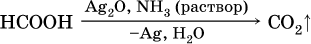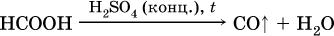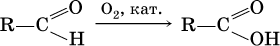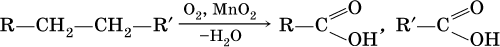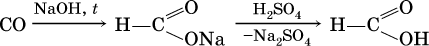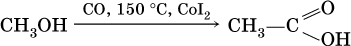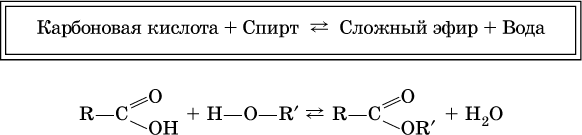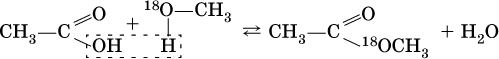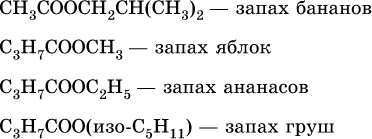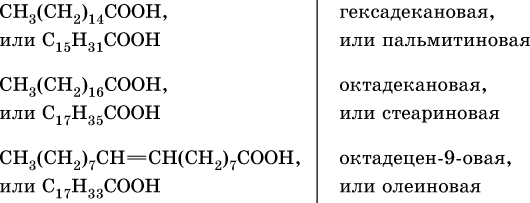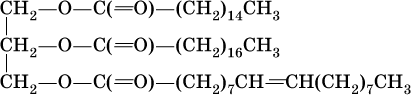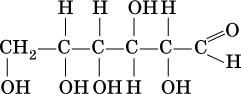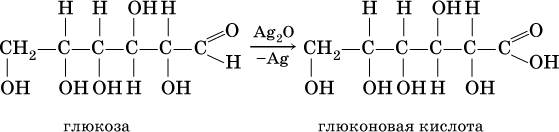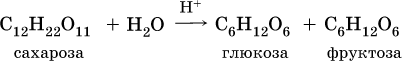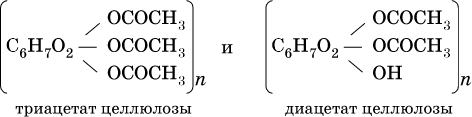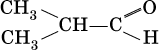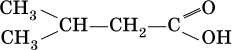чем отличаются по составу кислородсодержащие углеводороды разных классов
Тема 4. Урок 10.Кислородсодержащие углеводороды. Спирты и альдегиды
Тема 4. Урок 10.Кислородсодержащие углеводороды. Спирты и альдегиды
Продолжить формирование знаний о классах органических соединений, взаимосвязи между ними;
способствовать закреплению понимания взаимосвязи между строением, свойствами и применением органических веществ.
1. Обучающие: добиться усвоения понятия «спирты»; сформировать знания о составе, строении, номенклатуре спиртов, физиологическом воздействии на организм, физических и химических свойствах, способах получения, областях применения.
2. Развивающие : формировать умение делать выводы, сравнивать, работать с источниками информации (учебник, таблица, схема), высказывать суждения по изучаемым вопросам.
3.Воспитательные: формировать умение находить пути решения проблемных ситуаций, обосновывать свое решение адекватно поставленной проблеме.
а) образовательные: изучить гомологический ряд, виды изомерии, свойства применения альдегидов, обратив особое внимание на качественные реакции на альдегиды, актуализировать и углубить знания учащихся о способах получения альдегидов, изомерии и гомологии (гомологической разности).
б) развивающие: обогатить словарный запас через ведения новых понятий
(Карбонильная группа), уметь доказывать, анализировать, предвидеть свойства вещества по его строению; развивать умения учащихся составлять структурные формулы веществ по названию и называть вещества по структурной формуле, составлять для вещества формулы гомологов и изомеров, развивать логическое мышление.
в) воспитательные: продолжить формировать культуру общения через умение слушать, вести дискуссию, работу в парах (практическая работа) антиалкогольное воспитание, уважение к отечественной науке через работу русских учёных (патриотическое воспитание).
Оборудование : карточки с формулами, образцы соединений, оборудование к опытам, пакетик ванилина.
Мы познакомились с классом органических соединений – углеводородами. Сегодня мы приступаем к изучению соединений, которые отличаются по строению и свойствам от изученных ранее соединений.
Сначала давайте вспомним, что вы уже знаете об органических соединениях:
Какие органические вещества относятся к углеводородам?
Какой углеводород является родоначальником гомологического ряда алканов, алкенов, алкинов?
III . Изучение нового материала
К кислородсодержащим органическим соединениям относят многочисленные органические соединения, как природного происхождения, так и синтетические, являющиеся производными углеводородов, в молекулах которых содержатся углеродные атомы, непосредственно связанные с кислородом. В органических кислородсодержащих веществах кислород в соединении с углеродом образует различные группы, в которых углерод затрачивает на соединении с атомами кислорода одну, две или три валентные связи:
Остальные валентности углерода могут участвовать в образовании связи либо с углеродными атомами, либо с атомами водорода или других элементов.
Гидроксильная группа содержится в спиртах, карбонильная – в альдегидах и кетонах, карбоксильная – в карбоновых кислотах.
Кислородсодержащие органические соединения — соединения, содержащие в молекуле
связи углерод — водород и углерод — кислород. К кислородсодержащим относится большая часть органических соединений.
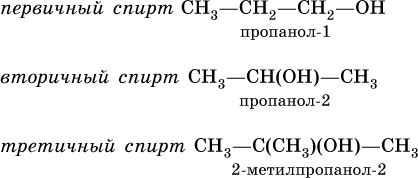
Спирты – органические вещества, в молекулах которых содержится одна или несколько гидроксогрупп (ОН).
В самом простом случае строение спирта можно выразить следующей формулой:
где R – углеводородный радикал
б) Классификация спиртов по числу гидроксильных групп:
Вопрос: Можно вывести общую формулу одноатомных и многоатомных спиртов?
( одна ОН группа) (две и более ОН групп)
СН 3 – ОН (метанол, древесный спирт) СН 2 ОН-СН 2 ОН (этандиол-1,2, этиленгликоль)
СН 3 – СН 2 – ОН (этанол, винный спирт) СН 2 ОН-СНОН-СН 2 ОН (пропантриол-1,2,3,
по характеру УВ радикала (предельные, непредельные, ароматические).
по характеру атома углерода, с которым связана гидроксильная группа ( первичные, вторичные, третичные)
Четвертичных спиртов не существует, т.к. четвертичный атом С связан с 4 другими атомами
в) Изучение физические свойства спиртов .
Лабораторный опыт «Физические свойства этилового спирта».
Учащиеся рассматривают внешний вид спирта, его растворимость в воде, делают запись в тетрадь с последующими коментариями: этиловый спирт – бесцветная жидкость со своеобразным запахом, хорошо растворимая в воде
1)Демонстрация: опыт «Взаимодействие этилового спирта с металлическим натрием».
Небольшой кусочек металлического натрия опускается в стакан со спиртом. Сверху стакан накрывается воронкой. Водород, выделяющийся в результате реакции, фиксируется при поднесении к носику воронки горящей лучины: раздаётся характерный хлопок.
2С 2 Н 5 ОН + 2Na = 2С 2 Н 5 ОNa + Н 2
2)для спиртов, как и для углеводородов, характерным свойством является горение. Один ученик у доски, остальные в тетрадях
д) название спиртов
Я хочу пригласить Вас в мир запахов. Запах это-
А как вы думаете, что такое запах? Обсуждение.Тысячи ароматов дарит нам природа. Душистые вещества в растениях обычно содержатся в цветках, листьях, кожуре плодов.
Чтобы выделить 1 кг розового масла, необходимо переработать3т лепестков роз. Чтобы запах был стойким, применяли продукт, вырабатываемый из желез самца оленя кабарги –мускус.
Как вы думаете, какое сырье можно и нужно использовать в современной парфюмерной промышленности, чтобы не уничтожить природу?
Предлагаю вам назвать вещество, источающее запах, по его описанию «Является основной составной частью духов и одеколонов(80%),используется для приготовления многих лекарственных препаратов, экстрактов, настоек, как антисептик в медицине, как ракетное топливо» (этанол).
Основой всех запахов являются не только спирты, но и более ароматные вещества.
Верхние ноты: бергамота, нероли, лимона
Средние ноты: ландыша, ириса, жасмина.
Базовые ноты: мускуса, ванили, сандалового дерева.
Стоимость Chanel №5 доходит до 165 у.е.
Для приготовления парфюмерной продукции используют альдегиды, которые хорошо растворяются в спирте и придают приятный запах. По проведенным опросам в парфюмерных магазинах среди покупателей практически никто из взрослых не смог ответить на вопрос: «Какие вещества называются альдегидами?»
а) определение и общая формула
Органические соединения, молекулы которых содержат карбонильну группу 
Альдегиды — это органические соединения, в молекулах которых атом Углерода карбонильной группы (карбонильний Карбон) связан с атомом Водорода.
Кетоны — это органические вещества, молекулы которых содержат карбонильну группу, соединенную с двумя углеводородными радикалами.
Чем отличаются по составу кислородсодержащие углеводороды разных классов
10. Кислородсодержащие органические соединения
10.1. Спирты. Простые эфиры. Фенолы
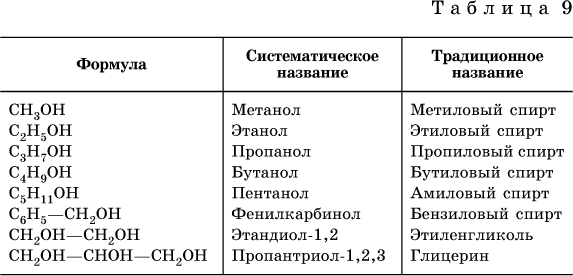
Спирты – производные углеводородов, содержащие функциональную группу ОН (гидроксил). Спирты, в которых имеется одна группа ОН, называются одноатомными, а спирты с несколькими группами ОН — многоатомными.
Названия некоторых распространенных спиртов приведены в табл. 9.
По строению различают спирты первичные, вторичные и третичные, в зависимости от того, при каком атоме углерода (первичном, вторичном или третичном) находится группа ОН:
Одноатомные спирты – бесцветные жидкости (до Cl2Н25ОН), растворимые в воде. Простейший спирт — метанол СН3ОН чрезвычайно ядовит. С увеличением молярной массы температура кипения спиртов повышается.
Молекулы жидких одноатомных спиртов ROH ассоциированы за счет водородных связей:
(эти связи аналогичны водородным связям в чистой воде).
При растворении в воде молекулы ROH образуют водородные связи с молекулами воды:
Водные растворы спиртов ROH имеют нейтральную среду; другими словами, спирты практически не диссоциируют в водном растворе ни по кислотному, ни по основному типу.
Химические свойства одноатомных спиртов обусловлены присутствием в них функциональной группы ОН.
Водород группы ОН в спиртах может замещаться на металл:
Этанолаты и производные других спиртов (алкоголяты) легко гидролизуются:
Группу ОН в спиртах можно заместить на Cl или Br:
При действии на спирты водоотнимающих средств, например концентрированной H2SO4, происходит межмолекулярная дегидратация:
Продукт реакции — диэтиловый эфир (С2Н5)2O – относится к классу простых эфиров.
В более жестких условиях дегидратация становится внутримолекулярной и образуется соответствующий алкен:
Многоатомные спирты рассмотрим на примере простейших представителей двух– и трехатомных спиртов:
При комнатной температуре они – бесцветные вязкие жидкости с температурами кипения 198 и 290 °C соответственно, неограниченно смешиваются с водой. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов подобны свойствам спиртов ROH. Так, в этиленгликоле одну или две группы ОН можно заместить на галоген:
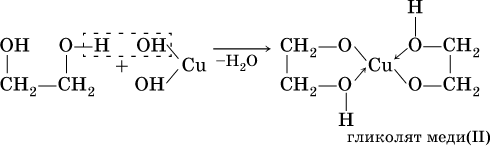
Кислотные свойства многоатомных спиртов проявляются в том, что (в отличие от одноатомных спиртов) водород группы ОН замещается на металл под действием не только металлов, но и гидроксидов металлов:
(стрелками в формуле гликолята меди показано образование ковалентных связей медь – кислород по донорно-акцепторному механизму).
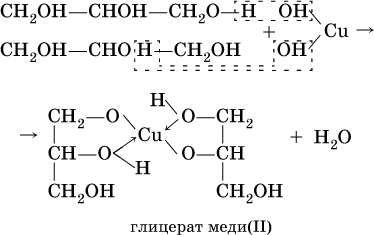
Аналогично реагирует с гидроксидом меди (II) глицерин:
Гликолят и глицерат меди (II), имеющие ярко-синюю окраску, позволяют качественно обнаруживать многоатомные спирты.
Получение одноатомных спиртов в промышленности – гидратация алкенов в присутствии катализаторов (H2SO4, Al2O3), причем присоединение воды к несимметричным алкенам происходит по правилу Марковникова:
(способ получения вторичного спирта), или присоединение к алкенам СО и Н2 в присутствии кобальтового катализатора (процесс называется гидрофоржилирование):
(способ получения первичного спирта).
В лаборатории (а иногда и в промышленности) спирты получают взаимодействием галогенпроизводных углеводородов с водой или водным раствором щелочи при нагревании:
Этанол С2Н5ОН образуется также при спиртовом брожении сахаристых веществ, например глюкозы:
Этиленгликоль получают в двухстадийном процессе:
а) окисление этилена:
б) гидратация этиленоксида:
Глицерин ранее получали омылением жиров (см. 20.3), современный трехстадийный способ – постепенное окисление пропена (приведена только схема процесса):
Спирты используют как сырье в органическом синтезе, в качестве растворителей (для лаков, красок и т. п.), а также в бумажной, полиграфической, парфюмерной, фармакологической и пищевой промышленности.
Простые эфиры – класс органических соединений, содержащих мостиковый атом кислорода – О– между двумя углеводородными радикалами: R – О—R’. Самый известный и широко применяемый простой эфир – диэтиловый эфир С2Н5—О – С2Н5. Бесцветная, легкоподвижная жидкость с характерным («эфирным») запахом, в лабораторной практике его называют просто эфиром. Почти не смешивается с водой, tкип = 34,51 °C. Пар эфира воспламеняется на воздухе. Получают диэтиловый эфир при межмолекулярной дегидратации этанола (см. выше), основное применение – растворитель.
Фенолы – это спирты, в которых группа ОН непосредственно связана с бензольным кольцом. Простейший представитель — фенол С6Н5—ОН. Белые (розовеющие на свету) кристаллы с сильным запахом, tпл = 41 °C. Вызывает ожоги кожи, ядовит.
Для фенола характерна значительно большая кислотность, чем для ациклических спиртов. Вследствие этого фенол в водном растворе легко реагирует с гидроксидом натрия:
Отсюда тривиальное название фенола — карболовая кислота.
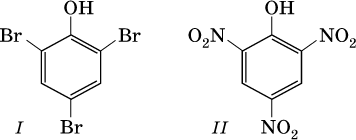
Отметим, что группа ОН в феноле никогда не замещается ни на какие другие группы или атомы, но делает более подвижными атомы водорода бензольного кольца. Так, фенол легко реагирует с бромом в воде и азотной кислотой, образуя соответственно 2,4,6-трибромфенол (I) и 2,4,6-тринитрофенол (II, традиционное название — пикриновая кислота):
Фенол в промышленности получают нагреванием хлорбензола с раствором гидроксида натрия под давлением при 250 °C:
Фенол применяют в качестве сырья для производства пластмасс и смол, полупродуктов для лакокрасочной и фармацевтической промышленности, как дезинфицирующее средство.
10.2. Альдегиды и кетоны
Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами.
Названия распространенных веществ этих классов приведены в табл. 10.
Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %-ного раствора— формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества.
Простейший кетон – пропанон-2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, tкип = 56,24 °C. Хорошо смешивается с водой.
Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.
В результате присоединения водорода к альдегидам образуются первичные спирты:
При восстановлении водородом кетонов образуются вторичные спирты:
Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
(действием разбавленных кислот такие продукты превращаются в альдегиды).
Окисление альдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению.
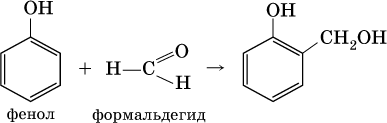
Альдегиды способны участвовать в реакциях конденсации. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
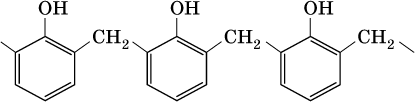
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации — фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
Аналогично протекает реакция с Cu(ОН)2, при нагревании появляется красный осадок оксида меди (I) Cu2O.
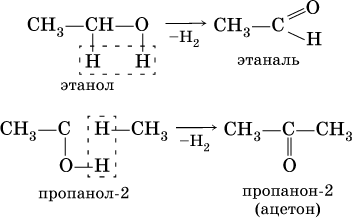
Получение: общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных спиртов получают альдегиды, а при дегидрировании вторичных спиртов – кетоны. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильными окислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
Более подходящим окислителем является оксид меди (II):
Ацетальдегид в промышленности получают по реакции Кучерова (см. 19.3).
Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ.
10.3. Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН (карбоксил).
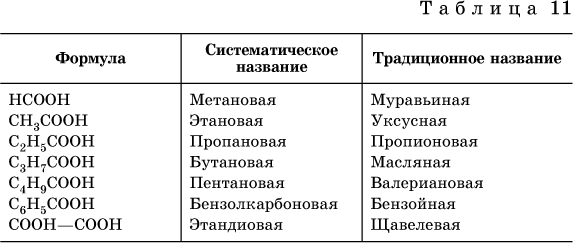
Формулы и названия некоторых распространенных карбоновых кислот приведены в табл. 11.
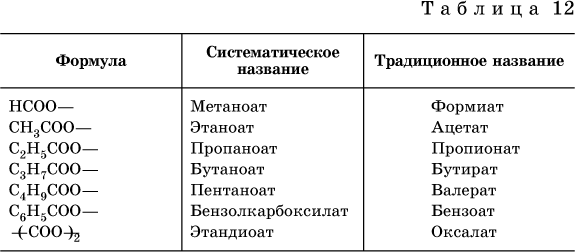
Традиционные названия кислот НСООН (муравьиная), СН3СООН (уксусная), С6Н5СООН (бензойная) и (СООН)2 (щавелевая) рекомендуется использовать вместо их систематических названий.
Формулы и названия кислотных остатков приведены в табл. 12.
Для составления названий солей этих карбоновых кислот (а также их сложных эфиров, см. ниже) обычно используются традиционные названия, например:
Низшие карбоновые кислоты – бесцветные жидкости с резким запахом. При увеличении молярной массы температура кипения возрастает.
Карбоновые кислоты обнаружены в природе:
Простейшие карбоновые кислоты растворимы в воде, обратимо диссоциируют в водном растворе с образованием катионов водорода:
и проявляют общие свойства кислот:
Важное практическое значение имеет взаимодействие карбоновых кислот со спиртами (подробнее см. ниже):
Отметим, что кислота НСООН вступает в реакцию «серебряного зеркала» как альдегиды:
и разлагается под действием водоотнимающих реактивов:
Кроме того, муравьиную кислоту получают по схеме:
а уксусную кислоту – по реакции:
Применяют муравьиную кислоту как протраву при крашении шерсти, консервант фруктовых соков, отбеливатель, дезинфекционный препарат. Уксусную кислоту используют как сырье в промышленном синтезе красителей, медикаментов, ацетатного волокна, негорючей кинопленки, органического стекла. Натриевые и калиевые соли высших карбоновых кислот – основные компоненты мыла.
Сложные эфиры – продукты обменного взаимодействия карбоновых кислот со спиртами. Это взаимодействие называется реакцией этерификации:
Механизм реакции этерификации был установлен при использовании спирта, меченного изотопом 18 O; этот кислород после реакции оказался в составе эфира (а не воды):
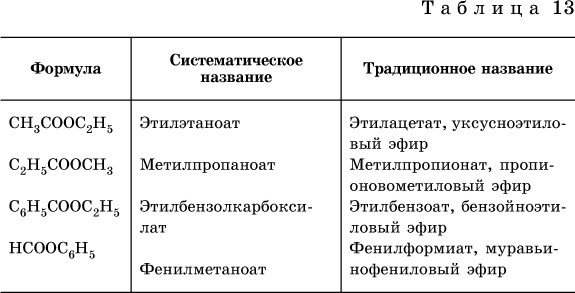
Формулы и названия распространенных сложных эфиров приведены в табл. 13.
Среди сложных эфиров есть бесцветные низкокипящие горючие жидкости с фруктовым запахом, например:
Используются сложные эфиры как растворители для лаков, красок и нитратов целлюлозы, носители фруктовых ароматов в пищевой промышленности.
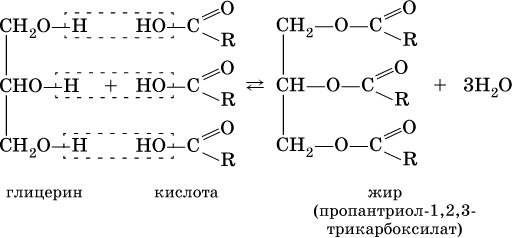
Сложные эфиры трехатомного спирта – глицерина и высших карбоновых кислот (в общем виде RCOOH), например с формулами и названиями:
носят названия жиров. Примером жира будет смешанный сложный эфир глицерина и этих кислот:
Чем выше содержание остатков олеиновой кислоты (или других ненасыщенных кислот), тем ниже температура плавления жира. Жидкие при комнатной температуре жиры называются маслами. Путем гидрогенизации, т. е. присоединения водорода по двойной связи, масла превращают в твердые жиры (например, растительное масло – в маргарин). Реакция этерификации (образования жира) обратима:
Прямая реакция лучше идет в кислотной среде, обратная реакция – гидролиз, или омыление, жира – в щелочной среде; при пищеварении жир омыляется (расщепляется) с помощью ферментов.
Углеводы (сахара) – важнейшие природные соединения, состоящие из углерода, водорода и кислорода. Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды не подвергаются гидролизу, а остальные углеводы при кипячении в присутствии кислот расщепляются до моносахаридов.
Моносахариды (и все другие углеводы) относятся к полифункциональным соединениям. В молекуле моносахарида имеются функциональные группы разных типов: группы ОН (спиртовая функция) и группы СО (альдегидная или кетонная функция). Поэтому различают альдозы (альдегидоспирты, спиртоальдегиды) и кетозы (кетоноспирты, спиртокетоны).
Важнейший представитель альдоз — глюкоза:
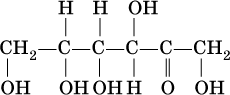
а представитель кетоз — фруктоза:
Глюкоза (виноградный сахар) и фруктоза (фруктовый сахар) являются структурными изомерами, их молекулярная формула С6Н12O6.
Глюкозу можно отличить от фруктозы так же, как любой альдегид от кетона, – по реакции «серебряного зеркала» в аммиачном растворе Ag2O:
Этерификация глюкозы и фруктозы (например, уксусной кислотой) приводит к образованию сложных эфиров по всем пяти группам ОН (заменяются на ОСОСН3).
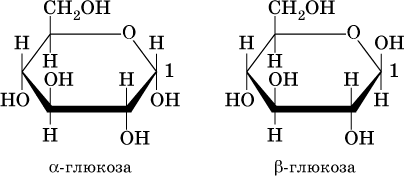
Циклические формы глюкозы не содержат альдегидной группы. Они отличаются друг от друга только пространственным расположением атома Н и группы ОН у атома углерода C1 (рядом с кислородом в цикле):
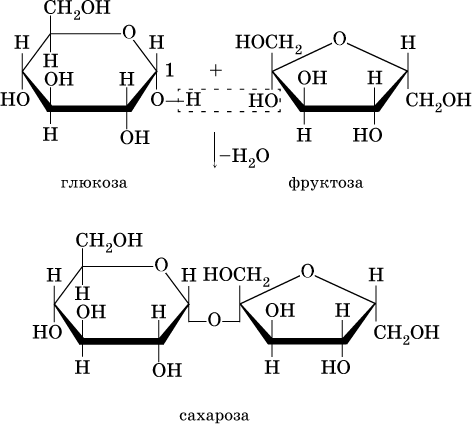
Дисахариды образуются из двух молекул моносахаридов путем межмолекулярной дегидратации. Так, сахароза (обычный сахар) C12Н22О11 является продуктом соединения остатков глюкозы и фруктозы за счет отщепления воды:
При гидролизе в кислотной среде сахароза вновь переходит в моносахариды:
Получившаяся смесь — инвертный сахар – содержится в мёде. При 200 °C сахароза, теряя воду, превращается в бурую массу (карамель).
Большое практическое значение имеют сложные эфиры целлюлозы с уксусной кислотой:
Их используют в производстве искусственного ацетатного волокна и кинофотопленок.
Примеры заданий частей А, В
1—2. Для соединения с формулой
правильное название – это
3) пропилэтиловый эфир
4) этилпропиловый эфир
3—4. Для соединения с формулой
правильное название – это
1) 1,1-диметилпропановая кислота
2) 3-метилбутановая кислота
5. Правильное название вещества CH3COOCH2CH3 – это
6. Водородные связи образуются между молекулами соединений
3) уксусная кислота
7. Для состава С4Н8O2 названия структурных изомеров из класса сложных эфиров – это
8—11. Формула соединения с названием
12. Для предельных одноатомных спиртов характерные реакции – это
13. Молекула конечного продукта реакции между фенолом и бромом в воде содержит общее число атомов всех элементов, равное
14—17. В уравнении реакции
14. окисления этанола оксидом меди (II)
15. бромирования фенола
16. межмолекулярной дегидратации этанола
17. нитрования фенола
сумма коэффициентов равна
18. В реакции этерификации группа ОН отщепляется от молекулы
19. С помощью хлорофилла в зеленом растении образуются
20—21. Химические свойства глюкозы, характерные для
проявляются в реакции
1) спиртового брожения
2) «серебряного зеркала»
22—24. При нагревании с водой в присутствии H2SO4 углевода
после окончания гидролиза получают
3) глюконовую кислоту
25. Способы получения этанола – это
1) гидратация этена
2) брожение глюкозы
3) восстановление этаналя
4) окисление этаналя
26. Способы получения этиленгликоля – это
2) гидратация этена
4) гидратация этина
27. Способы получения муравьиной кислоты – это
1) окисление метана
2) окисление фенола
3) окисление метанола
4) реакция СН3ОН с СО
28. Для синтеза уксусной кислоты используют соединения
29. Метанол применяется в производстве
30. Для распознавания фенола (в смеси с бутанолом-1) используют
1) индикатор и раствор щелочи
3) гидроксид меди (II)
4) аммиачный раствор оксида серебра (I)
31. Для распознавания в своих растворах глицерина, уксусной кислоты, ацетальдегида и глюкозы подходит один и тот же реактив
32. Органическое вещество – продукт гидратации ацетилена, которое вступает в реакцию «серебряного зеркала», а при восстановлении образует этанол, – это
2) уксусная кислота
33. Продукты А, Б, и В в схеме реакций СO2 + Н2O > фотосинтез А > брожение – СO2 Б > HCOOH B
3) пропановая кислота
34. Фенол будет участвовать в процессах:
6) «серебряного зеркала»
35. Возможно протекание реакций:
1) твердый жир + водород >…
2) муравьиная кислота + формальдегид >…
3) метанол + оксид меди (II) >…
6) этиленгликоль + NaOH (р-р) >…
36. Для промышленного синтеза фенолформальдегидной смолы следует взять набор реагентов